Instruction n° DGS/SP/SP1/2018/206 du 28 septembre 2018 relative à la mise en place d’une déclaration obligatoire de la rubéole
| Date de signature : | 28/09/2018 | Statut du texte : | En vigueur |
| Date de publication : | 15/12/2018 | Emetteur : | Ministère de la Santé |
| Consolidée le : | Source : | BO Santé n°2018-11 du 15 décembre 2018 | |
| Date d'entrée en vigueur : | 16/12/2018 |
Instruction n°DGS/SP/SP1/2018/206 du 28 septembre 2018 relative à la mise en place d’une déclaration obligatoire de la rubéole
NOR : SSAP1823738J
Date d’application : immédiate.
Validée par le CNP le 28 septembre 2018. – Visa CNP 2018-83.
Catégorie : mesures d’organisation des services retenues par la ministre pour la mise en œuvre des dispositions dont il s’agit.
Résumé : dans le cadre de ses engagements vis-à-vis de l’Organisation mondiale de la santé, la France s’est engagée à éliminer la rubéole, ce qui implique la mise en place d’un système performant de surveillance de cette maladie. une notification obligatoire de la rubéole est donc mise en place.
Mots clés : rubéole – vaccination – vaccination post-exposition – déclaration obligatoire – confirmation des cas.
Références :
Articles l. 3111-1, R. 3113-1 à R. 3113-5 et D. 3113-6 et 3113-7 du code de la santé publique ;
Arrêté du 22 août 2018 modifiant l’arrêté du 7 mai 2018 relatif à la notification obligatoire des cas de rubéole ;
Rapport du Haut Conseil de la santé publique relatif à la mise en place d’une déclaration obligatoire de la rubéole.
Annexes :
Annexe 1. – Critères de notification de la rubéole.
Annexe 2. – Évolution des marqueurs biologiques de la rubéole.
Annexe 2 bis. – Différents examens biologiques dans la rubéole (avantages et inconvénients)
Annexe 2 ter. – Circuit examen biologique CNR (rubéole).
Annexe 3. – Fiche d’information sur les kits de prélèvements de liquide buccal pour la confirmation biologique des cas de rubéole.
Annexe 4. – Fiche de notification obligatoire.
La ministre des solidarités et de la santé à Mesdames et Messieurs les directeurs généraux des agences régionales de santé (pour attribution et diffusion).
1. Justification de la mise en place d’une procédure de déclaration obligatoire de la rubéole
La France, comme l’ensemble des pays de la zone OMS, s’est engagée à éliminer la rougeole et la rubéole en adoptant la résolution EUR/RC60/R12 lors de la réunion du comité exécutif de septembre 2010. Cet engagement implique la mise en place d’une notification individuelle pour ces maladies afin d’être en mesure d’en certifier l’élimination. la déclaration obligatoire (DO) de la rougeole a été mise en place en 2005, en revanche, s’agissant de la rubéole, il n’existait pas jusqu’à aujourd’hui de système de surveillance en population générale ; celle-ci s’exerçant exclusivement sur les infections materno-fœtales.
La situation épidémiologique de la France (pays proche de l’élimination de la rubéole), la possibilité de surveillance par test salivaire (examen peu invasif, plus acceptable pour la population qu’un test sanguin), le risque de survenue de foyers épidémiques localisés du fait de la persistance de la circulation virale (même à un niveau faible), sont autant d’éléments justifiant la mise en place d’une déclaration obligatoire des cas de rubéole confirmés en population générale, tout en maintenant un système de surveillance particulier des infections rubéoleuses survenant pendant la grossesse et des rubéoles congénitales.
2. Prévention de la rubéole en France
La rubéole est une pathologie généralement bénigne, sa gravité est liée à la contamination lors de la grossesse avec un risque d’embryo-fœtopathie se traduisant par une mort fœtale ou une rubéole congénitale malformative. Cliniquement la rubéole se manifeste généralement par une fièvre modérée, une éruption, des adénopathies et des arthralgies ; toutefois elle est asymptomatique ou marquée par une symptomatologie non spécifique dans près de la moitié des cas.
La vaccination introduite chez l’adolescente dès 1970, et généralisée depuis, a considérablement fait reculer les cas de rubéoles congénitales (moins de 15 infections maternelles depuis 2006) en France. Si la couverture vaccinale atteint des taux rendant peu probable le risque de résurgence importante de la maladie, des risques d’émergence de foyers localisés de rubéole demeurent, du fait de l’hétérogénéité géographique de la couverture vaccinale ainsi que de l’existence d’une proportion plus élevée de réceptifs parmi les sujets de sexe masculin (1).
Depuis le 1er janvier 2018 cette vaccination est obligatoire et exigible depuis le 1er juin 2018 pour l’entrée en collectivité pour les enfants nés depuis le 1er janvier 2018.
La prévention de la rubéole repose sur un vaccin trivalent (rubéole, oreillons, rougeole) dont les modalités d’administration sont les suivantes : une première dose à l’âge de 12 mois et une seconde dose entre 16 et 18 mois. un rattrapage de la vaccination devrait être effectué pour toutes les personnes nées depuis 1980.
En outre, la vaccination est recommandée pour toute femme en âge de procréer non immunisée, née avant 1980. il n’est toutefois pas indiqué de revacciner les femmes ayant reçu deux doses de vaccins (2) trivalent actif contre la rubéole quelle que soit la sérologie si elle a été pratiquée, sachant que cet examen est inutile dans cette situation. Par ailleurs, lorsque des résultats de sérologie sont disponibles et confirment l’immunité, il n’y a pas lieu de pratiquer la vaccination contre la rubéole.
Chez la femme enceinte, lorsque les contrôles sérologiques (dépistage prénatal obligatoire des igG anti-rubéole depuis 1992) sont négatifs ou inconnus, la vaccination doit être proposée immédiatement après l’accouchement si possible avant la sortie de la maternité (voir calendrier des vaccinations). la vaccination contre la rubéole est contre-indiquée au cours de la grossesse, cependant, l’administration accidentelle du vaccin ne doit pas donner lieu à une interruption de la grossesse.
3. Procédure de notification

Cette mesure a pour objectifs principaux : 3
Tout cas de rubéole confirmé, doit être notifié immédiatement à l’agence régionale de santé (ARS) par le médecin ou le biologiste en charge du cas : les critères de notification sont précisés en annexe 1. la notification est réalisée au moyen de la fiche de notification qui figure en annexe 2 et qui est téléchargeable sur le site de Santé publique France : https ://www.formulaires.modernisation.gouv.fr/gf/cerfa_15917.do
Cette maladie faisant l’objet d’une procédure d’élimination en France, toute suspicion de rubéole clinique doit bénéficier d’une investigation biologique (5) (prélèvements à effectuer dans les plus brefs délais) qui, seule, permettra d’affirmer le diagnostic.
Dès réception de la fiche de DO, la personne en charge de la veille sanitaire à l’ARS devra s’assurer du respect des critères de notification, éliminer les doublons éventuels et contacter, le cas échéant, le déclarant afin de renseigner les données manquantes (6) les fiches de DO sont ensuite transmises par l’ARS à Santé publique France.
La rapidité de la mise en œuvre de la procédure signalement/notification permettra à l’ARS la mise en place de mesures de contrôle, particulièrement en cas de situation de cas groupés. Ces mesures reposent essentiellement sur la vaccination des sujets non immunisés4.
Les prélèvements à visée diagnostique peuvent être réalisés grâce à un prélèvement de liquide buccal (kit salivaire) par les médecins libéraux ; ils sont à adresser au CNR (7). Ces kits (identiques aux kits utilisés pour le diagnostic de rougeole), fournis par Santé publique France, sont pré-positionnés au niveau des ARS et peuvent être demandés par le praticien à l’ARS.
Les cas de rubéole chez la femme enceinte ainsi que les cas de rubéole congénitale feront l’objet d’un recueil d’information supplémentaire. un questionnaire spécifique similaire à celui utilisé dans le système de surveillance Renarub « Renarub-Clinicien (8) » sera adressé au clinicien par Santé publique France. Ce document recueillera les éléments suivants : tests de dépistage et de diagnostics réalisés pendant la grossesse, résultats permettant de dater l’infection (avidité des igG), évolution de la grossesse, signes cliniques présents à la naissance ou résultats anatomo-pathologiques en cas d’interruption de grossesse.
Ce questionnaire sera nominatif et permettra à Santé publique France de recueillir ces données complémentaires auprès de différents partenaires (CNR, centres de diagnostic prénatal, maternités, consultations ORl/ophtalmo...).
la surveillance par le réseau Renarub sera maintenue lors de la première année de mise en place
de la DO.
Vous voudrez bien prendre toutes les dispositions nécessaires à la mise en œuvre de cette déclaration obligatoire selon les modalités définies ; vous veillerez en particulier à rendre les kits salivaires accessibles aux cliniciens susceptibles de suspecter un cas de rubéole, à leur demande. Vous voudrez bien diffuser cette instruction :
Pour la ministre et par délégation :
Le directeur général de la santé,
J. Salomon
Vu au titre du CNP
par la secrétaire générale
des ministères chargés des affaires sociales,
S. Fourcade
(1) Vaccination contre la rubéole proposée chez les filles dès 1970 et pour les 2 sexes depuis 1983 (en association avec la rougeole).
(2) La preuve de la vaccination doit être apportée (carnet de santé ou certificat de vaccination).
(3) http://invs.santepubliquefrance.fr/espace-professionnels/Maladies-a-declaration-obligatoire/la-declaration-obligatoire-definitionobjectifs-criteres-acteurs
(4) Cf. guide de l’immunisation en post exposition du HCSP ; https://www.hcsp.fr/explore.cgi/avisrapportsdomaine?clefr=548
(5) S’agissant d’une procédure de surveillance les tests salivaires doivent être privilégiés.
(6) http://invs.santepubliquefrance.fr/espace-professionnels/Maladies-a-declaration-obligatoire/la-declaration-obligatoire-definitionobjectifs-criteres-acteurs
(7) CNR Rougeole, oreillons et rubéole - laboratoire de virologie humaine et moléculaire, CHu, avenue G. Clemenceau, 14033 Caen cedex – Tél. : 02 31 27 25 54 – Fax. : 02 31 27 25 57.
(8) http://invs.santepubliquefrance.fr/Dossiers-thematiques/Maladies-infectieuses/Maladies-a-prevention-vaccinale/Rubeole
ANNEXE 1
CRITÈRES DE NOTIFICATION DE LA RUBÉOLE

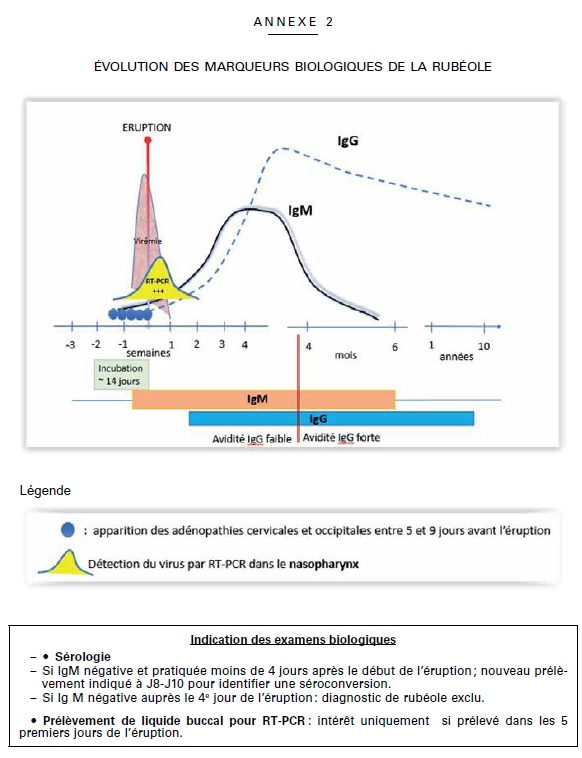
ANNEXE 2 B I S
DIFFÉRENTS EXAMENS BIOLOGIQUE S DANS LA RUBÉOLE
(AVANTAGES ET INCONVÉNIENTS)
Cf. : https://www.hcsp.fr/explore.cgi/avisrapportsdomaine?clef=622
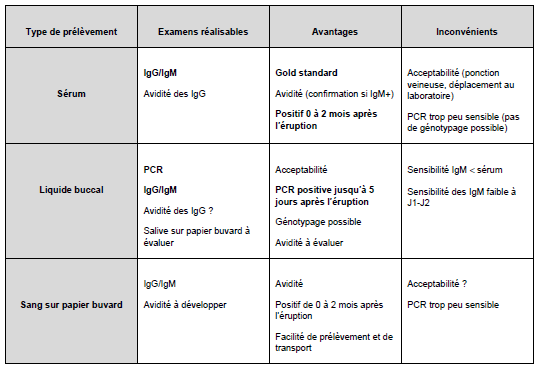
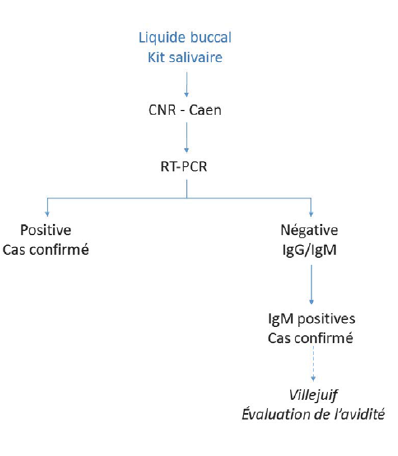
ANNEXE 2 TER
CIRCUIT EXAMEN BIOLOGIQUE CNR (RUBÉOLE)
ANNEXE 3
FICHE D’INFORMATION SUR LES KITS DE PRÉLÈVEMENT DE LIQUI DE BUCCAL POUR LA CONFIRMATION BIOLOGIQUE DES CAS DE RUBÉOLE
Positionnement des stocks de kits de prélèvements
Afin d’aider à la confirmation des cas, des kits de prélèvements de liquide buccal, communs au diagnostic biologique de la rougeole et de la rubéole, sont positionnés au niveau des ARS et des DD, en charge de leur gestion au niveau régional. Santé publique France assure la gestion d’un stock national afin de répondre à la demande des ARS pour le renouvellement de leurs stocks.
Pour se réapprovisionner, les ARS doivent faire une demande de kits auprès du département des maladies infectieuses de Santé publique France(1) en utilisant l’adresse mail suivante : [email protected].
Approvisionnement des médecins
Ces kits sont mis à disposition des médecins libéraux. Ils ont la possibilité de faire une demande de kits auprès de la DD ou de l’ARS (par fax, téléphone ou par l’intermédiaire de la fiche de DO).
Les ARS/DD envoient aux médecins par voie postale les kits demandés.

Intérêt des prélèvements salivaires
Ce prélèvement permettra la mise en évidence par le CNR : de l’ARN viral par PCR (optimale de J1 à J5) et d’IgM spécifiques (apparaissant dans la salive à peu près en même temps que dans le sang, avec une sensibilité plus faible à J1 et J2).
Ce prélèvement est non-invasif. Il suffit de frotter la face interne des joues/gencives du malade pendant 1 minute environ avec la petite éponge fournie jusqu’à ce que celle-ci soit imbibée de salive.
Une fois le prélèvement réalisé, l’écouvillon est remis dans le tube plastique qui est identifié par une étiquette sur laquelle doivent être inscrits le nom, le prénom et la date de naissance du patient.
Puis ce tube est placé dans la boîte de transport qui est placée dans l’enveloppe L’envoi peut se faire à température ambiante, par voie postale normale.
La fiche de renseignements complétée doit accompagner le prélèvement et faire apparaître les coordonnées du médecin prescripteur.
Les analyses des prélèvements sont gratuites pour le patient.
Les résultats seront ensuite adressés par le CNR au médecin prescripteur.
1 Santé publique France, département des maladies infectieuses, 12 rue du Val-d’Osne, 94415 Saint-Maurice Cedex – Tél. : 01 41 79 67 00 – Fax. : 01 41 79 68 72
2 CNR Rougeole, oreillons rubéole : Laboratoire de virologie humaine et moléculaire, CHU, avenue G. Clemenceau, 14033 Caen Cedex – Tél. : 02 31 27 25 54 – Fax. : 02 31 27 25 57

NOR : SSAP1823738J
Date d’application : immédiate.
Validée par le CNP le 28 septembre 2018. – Visa CNP 2018-83.
Catégorie : mesures d’organisation des services retenues par la ministre pour la mise en œuvre des dispositions dont il s’agit.
Résumé : dans le cadre de ses engagements vis-à-vis de l’Organisation mondiale de la santé, la France s’est engagée à éliminer la rubéole, ce qui implique la mise en place d’un système performant de surveillance de cette maladie. une notification obligatoire de la rubéole est donc mise en place.
Mots clés : rubéole – vaccination – vaccination post-exposition – déclaration obligatoire – confirmation des cas.
Références :
Articles l. 3111-1, R. 3113-1 à R. 3113-5 et D. 3113-6 et 3113-7 du code de la santé publique ;
Arrêté du 22 août 2018 modifiant l’arrêté du 7 mai 2018 relatif à la notification obligatoire des cas de rubéole ;
Rapport du Haut Conseil de la santé publique relatif à la mise en place d’une déclaration obligatoire de la rubéole.
Annexes :
Annexe 1. – Critères de notification de la rubéole.
Annexe 2. – Évolution des marqueurs biologiques de la rubéole.
Annexe 2 bis. – Différents examens biologiques dans la rubéole (avantages et inconvénients)
Annexe 2 ter. – Circuit examen biologique CNR (rubéole).
Annexe 3. – Fiche d’information sur les kits de prélèvements de liquide buccal pour la confirmation biologique des cas de rubéole.
Annexe 4. – Fiche de notification obligatoire.
La ministre des solidarités et de la santé à Mesdames et Messieurs les directeurs généraux des agences régionales de santé (pour attribution et diffusion).
1. Justification de la mise en place d’une procédure de déclaration obligatoire de la rubéole
La France, comme l’ensemble des pays de la zone OMS, s’est engagée à éliminer la rougeole et la rubéole en adoptant la résolution EUR/RC60/R12 lors de la réunion du comité exécutif de septembre 2010. Cet engagement implique la mise en place d’une notification individuelle pour ces maladies afin d’être en mesure d’en certifier l’élimination. la déclaration obligatoire (DO) de la rougeole a été mise en place en 2005, en revanche, s’agissant de la rubéole, il n’existait pas jusqu’à aujourd’hui de système de surveillance en population générale ; celle-ci s’exerçant exclusivement sur les infections materno-fœtales.
La situation épidémiologique de la France (pays proche de l’élimination de la rubéole), la possibilité de surveillance par test salivaire (examen peu invasif, plus acceptable pour la population qu’un test sanguin), le risque de survenue de foyers épidémiques localisés du fait de la persistance de la circulation virale (même à un niveau faible), sont autant d’éléments justifiant la mise en place d’une déclaration obligatoire des cas de rubéole confirmés en population générale, tout en maintenant un système de surveillance particulier des infections rubéoleuses survenant pendant la grossesse et des rubéoles congénitales.
2. Prévention de la rubéole en France
La rubéole est une pathologie généralement bénigne, sa gravité est liée à la contamination lors de la grossesse avec un risque d’embryo-fœtopathie se traduisant par une mort fœtale ou une rubéole congénitale malformative. Cliniquement la rubéole se manifeste généralement par une fièvre modérée, une éruption, des adénopathies et des arthralgies ; toutefois elle est asymptomatique ou marquée par une symptomatologie non spécifique dans près de la moitié des cas.
La vaccination introduite chez l’adolescente dès 1970, et généralisée depuis, a considérablement fait reculer les cas de rubéoles congénitales (moins de 15 infections maternelles depuis 2006) en France. Si la couverture vaccinale atteint des taux rendant peu probable le risque de résurgence importante de la maladie, des risques d’émergence de foyers localisés de rubéole demeurent, du fait de l’hétérogénéité géographique de la couverture vaccinale ainsi que de l’existence d’une proportion plus élevée de réceptifs parmi les sujets de sexe masculin (1).
Depuis le 1er janvier 2018 cette vaccination est obligatoire et exigible depuis le 1er juin 2018 pour l’entrée en collectivité pour les enfants nés depuis le 1er janvier 2018.
La prévention de la rubéole repose sur un vaccin trivalent (rubéole, oreillons, rougeole) dont les modalités d’administration sont les suivantes : une première dose à l’âge de 12 mois et une seconde dose entre 16 et 18 mois. un rattrapage de la vaccination devrait être effectué pour toutes les personnes nées depuis 1980.
En outre, la vaccination est recommandée pour toute femme en âge de procréer non immunisée, née avant 1980. il n’est toutefois pas indiqué de revacciner les femmes ayant reçu deux doses de vaccins (2) trivalent actif contre la rubéole quelle que soit la sérologie si elle a été pratiquée, sachant que cet examen est inutile dans cette situation. Par ailleurs, lorsque des résultats de sérologie sont disponibles et confirment l’immunité, il n’y a pas lieu de pratiquer la vaccination contre la rubéole.
Chez la femme enceinte, lorsque les contrôles sérologiques (dépistage prénatal obligatoire des igG anti-rubéole depuis 1992) sont négatifs ou inconnus, la vaccination doit être proposée immédiatement après l’accouchement si possible avant la sortie de la maternité (voir calendrier des vaccinations). la vaccination contre la rubéole est contre-indiquée au cours de la grossesse, cependant, l’administration accidentelle du vaccin ne doit pas donner lieu à une interruption de la grossesse.
3. Procédure de notification
Cette mesure a pour objectifs principaux : 3
- le suivi de la situation épidémiologique de la rubéole en France ainsi que les progrès vers l’élimination ;
- la détection des rubéoles survenant au cours de la grossesse ainsi que des rubéoles congénitales ;
- l’identification des cas groupés afin de mettre en œuvre rapidement des mesures de contrôle, compte tenu du potentiel épidémique de la rubéole.
Tout cas de rubéole confirmé, doit être notifié immédiatement à l’agence régionale de santé (ARS) par le médecin ou le biologiste en charge du cas : les critères de notification sont précisés en annexe 1. la notification est réalisée au moyen de la fiche de notification qui figure en annexe 2 et qui est téléchargeable sur le site de Santé publique France : https ://www.formulaires.modernisation.gouv.fr/gf/cerfa_15917.do
- le déclarant peut notifier par téléphone ou fax puis envoyer secondairement la fiche de DO à l’ARS par voie postale sous pli confidentiel portant la mention « secret médical » ;
- le déclarant peut également envoyer immédiatement la fiche de DO, même incomplète si les critères de notification sont renseignés ; les informations manquantes pourront être renseignées ultérieurement en lien avec l’ARS.
Cette maladie faisant l’objet d’une procédure d’élimination en France, toute suspicion de rubéole clinique doit bénéficier d’une investigation biologique (5) (prélèvements à effectuer dans les plus brefs délais) qui, seule, permettra d’affirmer le diagnostic.
Dès réception de la fiche de DO, la personne en charge de la veille sanitaire à l’ARS devra s’assurer du respect des critères de notification, éliminer les doublons éventuels et contacter, le cas échéant, le déclarant afin de renseigner les données manquantes (6) les fiches de DO sont ensuite transmises par l’ARS à Santé publique France.
La rapidité de la mise en œuvre de la procédure signalement/notification permettra à l’ARS la mise en place de mesures de contrôle, particulièrement en cas de situation de cas groupés. Ces mesures reposent essentiellement sur la vaccination des sujets non immunisés4.
Les prélèvements à visée diagnostique peuvent être réalisés grâce à un prélèvement de liquide buccal (kit salivaire) par les médecins libéraux ; ils sont à adresser au CNR (7). Ces kits (identiques aux kits utilisés pour le diagnostic de rougeole), fournis par Santé publique France, sont pré-positionnés au niveau des ARS et peuvent être demandés par le praticien à l’ARS.
Les cas de rubéole chez la femme enceinte ainsi que les cas de rubéole congénitale feront l’objet d’un recueil d’information supplémentaire. un questionnaire spécifique similaire à celui utilisé dans le système de surveillance Renarub « Renarub-Clinicien (8) » sera adressé au clinicien par Santé publique France. Ce document recueillera les éléments suivants : tests de dépistage et de diagnostics réalisés pendant la grossesse, résultats permettant de dater l’infection (avidité des igG), évolution de la grossesse, signes cliniques présents à la naissance ou résultats anatomo-pathologiques en cas d’interruption de grossesse.
Ce questionnaire sera nominatif et permettra à Santé publique France de recueillir ces données complémentaires auprès de différents partenaires (CNR, centres de diagnostic prénatal, maternités, consultations ORl/ophtalmo...).
la surveillance par le réseau Renarub sera maintenue lors de la première année de mise en place
de la DO.
Vous voudrez bien prendre toutes les dispositions nécessaires à la mise en œuvre de cette déclaration obligatoire selon les modalités définies ; vous veillerez en particulier à rendre les kits salivaires accessibles aux cliniciens susceptibles de suspecter un cas de rubéole, à leur demande. Vous voudrez bien diffuser cette instruction :
- aux directeurs d’établissements de santé publics et privés de votre région, en leur demandant de la transmettre aux professionnels concernés ;
- aux conseils départementaux des ordres des médecins pour diffusion auprès des médecins libéraux ;
- aux unions régionales des médecins libéraux ;
- aux services de promotion de la santé en faveur des élèves ;
- aux services de santé universitaire ;
- aux conseils départementaux, notamment aux services de protection maternelle et infantile pour diffusion aux services d’accueil de l’enfance ;
- aux municipalités pour diffusion à leurs services d’hygiène et de santé et leurs établissements d’accueil de l’enfance ;
- aux établissements d’accueil de l’enfance agréés par le ministère de l’éducation nationale ;
- aux laboratoires de biologie médicale ;
- et toutes autres structures que vous jugeriez utile d’informer.
Pour la ministre et par délégation :
Le directeur général de la santé,
J. Salomon
Vu au titre du CNP
par la secrétaire générale
des ministères chargés des affaires sociales,
S. Fourcade
(1) Vaccination contre la rubéole proposée chez les filles dès 1970 et pour les 2 sexes depuis 1983 (en association avec la rougeole).
(2) La preuve de la vaccination doit être apportée (carnet de santé ou certificat de vaccination).
(3) http://invs.santepubliquefrance.fr/espace-professionnels/Maladies-a-declaration-obligatoire/la-declaration-obligatoire-definitionobjectifs-criteres-acteurs
(4) Cf. guide de l’immunisation en post exposition du HCSP ; https://www.hcsp.fr/explore.cgi/avisrapportsdomaine?clefr=548
(5) S’agissant d’une procédure de surveillance les tests salivaires doivent être privilégiés.
(6) http://invs.santepubliquefrance.fr/espace-professionnels/Maladies-a-declaration-obligatoire/la-declaration-obligatoire-definitionobjectifs-criteres-acteurs
(7) CNR Rougeole, oreillons et rubéole - laboratoire de virologie humaine et moléculaire, CHu, avenue G. Clemenceau, 14033 Caen cedex – Tél. : 02 31 27 25 54 – Fax. : 02 31 27 25 57.
(8) http://invs.santepubliquefrance.fr/Dossiers-thematiques/Maladies-infectieuses/Maladies-a-prevention-vaccinale/Rubeole
ANNEXE 1
CRITÈRES DE NOTIFICATION DE LA RUBÉOLE
ANNEXE 2 B I S
DIFFÉRENTS EXAMENS BIOLOGIQUE S DANS LA RUBÉOLE
(AVANTAGES ET INCONVÉNIENTS)
Cf. : https://www.hcsp.fr/explore.cgi/avisrapportsdomaine?clef=622
ANNEXE 2 TER
CIRCUIT EXAMEN BIOLOGIQUE CNR (RUBÉOLE)
ANNEXE 3
FICHE D’INFORMATION SUR LES KITS DE PRÉLÈVEMENT DE LIQUI DE BUCCAL POUR LA CONFIRMATION BIOLOGIQUE DES CAS DE RUBÉOLE
Positionnement des stocks de kits de prélèvements
Afin d’aider à la confirmation des cas, des kits de prélèvements de liquide buccal, communs au diagnostic biologique de la rougeole et de la rubéole, sont positionnés au niveau des ARS et des DD, en charge de leur gestion au niveau régional. Santé publique France assure la gestion d’un stock national afin de répondre à la demande des ARS pour le renouvellement de leurs stocks.
Pour se réapprovisionner, les ARS doivent faire une demande de kits auprès du département des maladies infectieuses de Santé publique France(1) en utilisant l’adresse mail suivante : [email protected].
Approvisionnement des médecins
Ces kits sont mis à disposition des médecins libéraux. Ils ont la possibilité de faire une demande de kits auprès de la DD ou de l’ARS (par fax, téléphone ou par l’intermédiaire de la fiche de DO).
Les ARS/DD envoient aux médecins par voie postale les kits demandés.
Intérêt des prélèvements salivaires
Ce prélèvement permettra la mise en évidence par le CNR : de l’ARN viral par PCR (optimale de J1 à J5) et d’IgM spécifiques (apparaissant dans la salive à peu près en même temps que dans le sang, avec une sensibilité plus faible à J1 et J2).
Ce prélèvement est non-invasif. Il suffit de frotter la face interne des joues/gencives du malade pendant 1 minute environ avec la petite éponge fournie jusqu’à ce que celle-ci soit imbibée de salive.
Une fois le prélèvement réalisé, l’écouvillon est remis dans le tube plastique qui est identifié par une étiquette sur laquelle doivent être inscrits le nom, le prénom et la date de naissance du patient.
Puis ce tube est placé dans la boîte de transport qui est placée dans l’enveloppe L’envoi peut se faire à température ambiante, par voie postale normale.
La fiche de renseignements complétée doit accompagner le prélèvement et faire apparaître les coordonnées du médecin prescripteur.
Les analyses des prélèvements sont gratuites pour le patient.
Les résultats seront ensuite adressés par le CNR au médecin prescripteur.
1 Santé publique France, département des maladies infectieuses, 12 rue du Val-d’Osne, 94415 Saint-Maurice Cedex – Tél. : 01 41 79 67 00 – Fax. : 01 41 79 68 72
2 CNR Rougeole, oreillons rubéole : Laboratoire de virologie humaine et moléculaire, CHU, avenue G. Clemenceau, 14033 Caen Cedex – Tél. : 02 31 27 25 54 – Fax. : 02 31 27 25 57